1、 常見的金屬活性順序表
在初學化學的時候,就學習過金屬活性順序表。并從中知道,前面的金屬可以把后面的金屬從他們的可溶性鹽中置換出來(除K、Ca、Na)
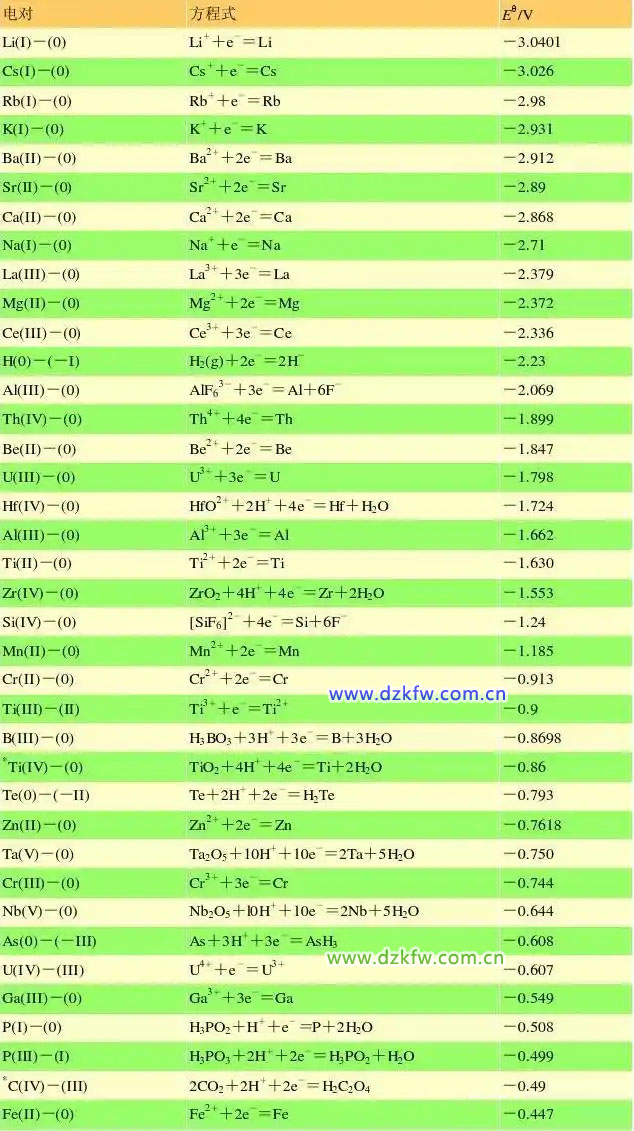
金屬活性順序表
可是,這樣的金屬活動性順序表,你見過嗎?
從這張表中,身為鋰電池從業者的你發現了什么?是不是特別刺眼?鋰!鋰!鋰!居然位于表頭,我的天呢,這是什么鬼?
鎂銅組成原電池中,鎂為負極,可以置換出銅,這是是毫無疑問的,這也是我們經常用來判斷兩種金屬活潑性常用方法。
那么,鋰和鎂組成標準的原電池鋰是負極,并置換出鎂嗎?
Yes,You are right!
2、金屬性越強的金屬與酸或水反應就越劇烈?
接下來,問題來了,金屬活動性最強的確是鋰,它與酸或水反應就越劇烈嗎?這個就未必!是的,未必!
(1)金屬活動性是個熱力學標準,由標態下的金屬的電極電勢決定,φθ(Li+/Li) =-3.042V,若把金屬Li排到金屬活動性順序表中,自然就排在最前面了。
Li的水化熱最負,造成了鋰的電極電勢最低,并不代表Li的金屬性最強。
另外鋰電勢最負,與其原子結構有關,及發生反應的難易程度有關(能量變化)。鋰(Li)的原子核外共有3個電子,第1電子層有2個電子,最外電子層有1個電子。
(2)活潑性越強的金屬與水或酸反應的快、慢,是一動力學范疇,金屬性越強,一般反應越劇烈。
為什么Li與水的反應慢,原因簡析如下
ü LiOH的溶解度小,包覆在Li的表面,阻礙了反應的進一步進行,宏觀上看,就是和水反應不劇烈
ü Li熔點高,反應產生的熱不足以使Li熔化,因而固態的Li與水的接觸面不如液態的大
ü Li+的水合半徑打,移動緩慢,難以擴散到溶液的本體里去,致使反應速率減慢
3、 鋰-電池材料之首選
φθ(Li+/Li) =-3.042V,為了提升安全性及電壓,負極采用石墨及鈷酸鋰等材料來儲存鋰原子。這些材料的分子結構,形成了納米等級的細小儲存格子,可用來儲存鋰原子,以此,形成一個低電位電極。






 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底